Termodinamikoje, tiriant perėjimus iš pradinės į galutinę sistemos būseną, svarbu žinoti proceso šiluminį poveikį. Šilumos talpos sąvoka yra glaudžiai susijusi su šiuo efektu. Šiame straipsnyje mes apsvarstysime klausimą, ką reiškia dujų izochorinė šiluminė talpa.
Idealios dujos
Idealios dujos yra dujos, kurių dalelės laikomos materialiais taškais, tai yra, jos neturi matmenų, bet turi masę ir kurių visą vidinę energiją sudaro tik molekulių judėjimo kinetinė energija ir atomai.
Bet kokios tikros dujos idealiu atveju niekada nepatenkins aprašyto modelio, nes jų dalelės vis dar turi tam tikrus linijinius matmenis ir sąveikauja viena su kita naudodamos silpnus van der Waals ryšius arba kito tipo cheminius ryšius. Tačiau esant žemam slėgiui ir aukštai temperatūrai atstumai tarp molekulių yra dideli, o jų kinetinė energija dešimtis kartų viršija potencialią energiją. Visa tai leidžia labai tiksliai pritaikyti idealų modelį tikroms dujoms.
Vidinė dujų energija
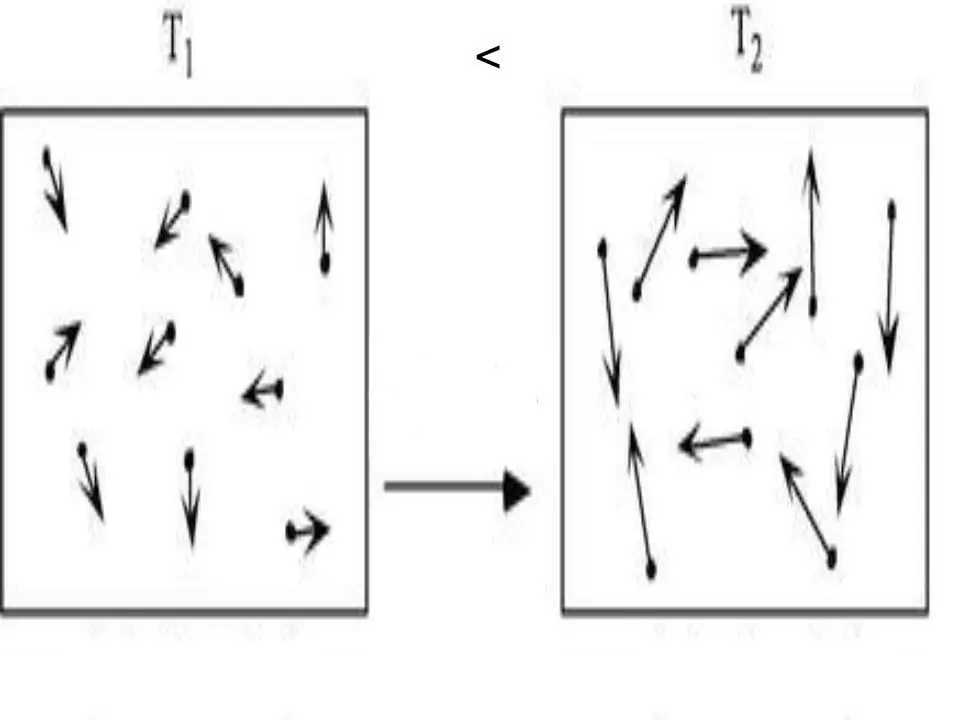
Bet kurios sistemos vidinė energija yra fizinė charakteristika, lygi potencialios ir kinetinės energijos sumai. Kadangi idealiose dujose potencialios energijos galima nepaisyti, galime parašyti jų lygybę:
U=Ek.
Kur Ek yra kinetinės sistemos energija. Naudojant molekulinę kinetinę teoriją ir taikant universalią Clapeyrono-Mendelejevo būsenos lygtį, nesunku gauti U išraišką. Parašyta žemiau:
U=z/2nRT.
Čia T, R ir n yra atitinkamai absoliuti temperatūra, dujų konstanta ir medžiagos kiekis. z reikšmė yra sveikasis skaičius, nurodantis dujų molekulės laisvės laipsnių skaičių.
Izobarinė ir izochorinė šiluminė talpa
Fizikoje šiluminė talpa yra šilumos kiekis, kuris turi būti tiekiamas tiriamai sistemai, kad ji sušildytų vienu kelvinu. Taip pat galioja atvirkštinis apibrėžimas, ty šiluminė talpa yra šilumos kiekis, kurį sistema išskiria atvėsusi vienu kelvinu.
Lengviausias būdas sistemai yra nustatyti izochorinę šiluminę galią. Jis suprantamas kaip šilumos talpa esant pastoviam tūriui. Kadangi sistema tokiomis sąlygomis darbo neatlieka, visa energija išleidžiama vidinių energijos atsargų didinimui. Izochorinę šiluminę talpą pažymėkime simboliu CV, tada galime parašyti:
dU=CVdT.
Tai yra vidinės energijos pokytissistema yra tiesiogiai proporcinga jos temperatūros pokyčiui. Jei palyginsime šią išraišką su lygybe, parašyta ankstesnėje pastraipoje, tada gausime formulę CV idealiose dujose:
СV=z/2nR.
Šią reikšmę praktiškai naudoti nepatogu, nes ji priklauso nuo medžiagos kiekio sistemoje. Todėl buvo įvesta specifinės izochorinės šiluminės talpos sąvoka, tai yra vertė, kuri apskaičiuojama arba 1 moliui dujų, arba 1 kg. Pirmąją reikšmę pažymėkime simboliu CV, antrąją - simboliu CV m. Jiems galite parašyti šias formules:
CV=z/2R;
CVm=z/2R/M.
Čia M yra molinė masė.
Izobarinė yra šiluminė talpa, išlaikant pastovų slėgį sistemoje. Tokio proceso pavyzdys yra dujų išsiplėtimas cilindre po stūmokliu, kai jis šildomas. Skirtingai nuo izochorinio proceso, izobarinio proceso metu į sistemą tiekiama šiluma išleidžiama vidinei energijai padidinti ir mechaniniam darbui atlikti, tai yra:
H=dU + PdV.
Izobarinio proceso entalpija yra izobarinės šiluminės talpos ir temperatūros pokyčio sistemoje sandauga, tai yra:
H=CPdT.
Jei laikysime plėtimąsi esant pastoviam 1 molio dujų slėgiui, pirmasis termodinamikos dėsnis bus parašytas taip:
CPdT=CV dT + RdT.
Paskutinis narys gaunamas iš lygtiesClapeyronas-Mendelejevas. Iš šios lygybės išplaukia santykis tarp izobarinės ir izochorinės šiluminės talpos:
CP=CV + R.
Idealioms dujoms savitoji molinė šiluminė talpa esant pastoviam slėgiui visada yra didesnė už atitinkamą izochorinę charakteristiką, kai R=8, 314 J/(molK).
Molekulių laisvės ir šiluminės talpos laipsniai
Parašykime dar kartą konkrečios molinės izochorinės šiluminės talpos formulę:
CV=z/2R.
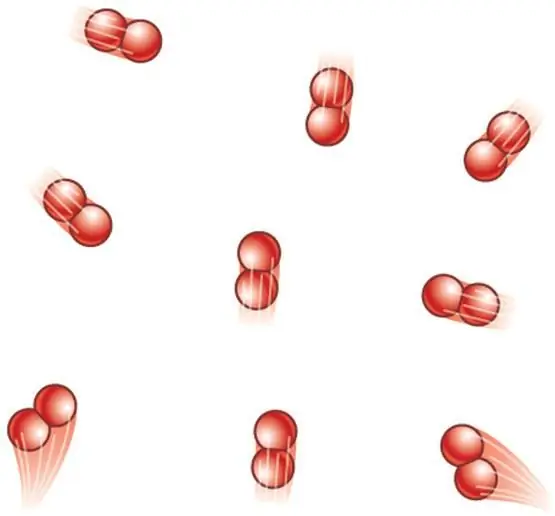
Monatominių dujų atveju reikšmė z=3, nes atomai erdvėje gali judėti tik trimis nepriklausomomis kryptimis.
Jei kalbame apie dujas, kurias sudaro dviatomės molekulės, pavyzdžiui, deguonis O2 arba vandenilis H2, tada, be transliacinio judėjimo, šios molekulės vis tiek gali suktis aplink dvi viena kitai statmenas ašis, tai yra, z bus lygus 5.
Sudėtingesnėms molekulėms naudokite z=6., kad nustatytumėte CV






