Idealiųjų dujų savybių tyrimas yra svarbi fizikos tema. Įvadas į dujų sistemų charakteristikas prasideda Boyle-Mariotte lygties svarstymu, nes tai yra pirmasis eksperimentiškai atrastas idealių dujų dėsnis. Apsvarstykime tai išsamiau straipsnyje.
Ką reiškia idealios dujos?
Prieš kalbėdami apie Boyle-Mariotte dėsnį ir jį apibūdinančią lygtį, apibrėžkime idealias dujas. Paprastai ji suprantama kaip skysta medžiaga, kurioje ją sudarančios dalelės nesąveikauja viena su kita, o jų dydžiai yra nežymiai maži, palyginti su vidutiniais atstumais tarp dalelių.
Tiesą sakant, bet kurios dujos yra tikros, tai yra, jas sudarantys atomai ir molekulės turi tam tikrą dydį ir nesąveikauja viena su kita van der Waalso jėgų pagalba. Tačiau esant aukštai absoliučiai temperatūrai (daugiau nei 300 K) ir žemam slėgiui (mažiau nei viena atmosfera), atomų ir molekulių kinetinė energija yra daug didesnė nei van der Waalso sąveikos energija, todėl tikrosios dujos nurodytojedidelio tikslumo sąlygos gali būti laikomos idealiomis.
Boyle-Mariotte lygtis
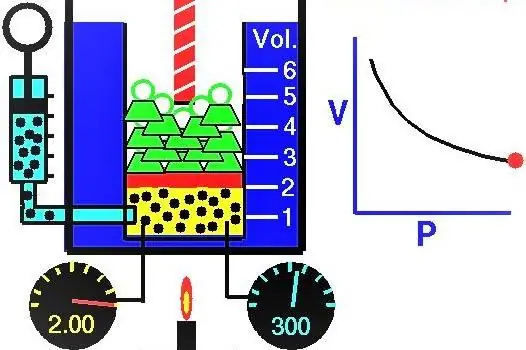
Dujų savybės Europos mokslininkai aktyviai tyrinėjo XVII-XIX a. Pats pirmasis eksperimentiniu būdu atrastas dujų dėsnis buvo dėsnis, aprašantis izoterminius dujų sistemos plėtimosi ir suspaudimo procesus. Atitinkamus eksperimentus atliko Robertas Boyle'as 1662 m. ir Edm Mariotte 1676 m. Kiekvienas iš šių mokslininkų savarankiškai parodė, kad izoterminio proceso metu uždaroje dujų sistemoje slėgis keičiasi atvirkščiai tūriui. Eksperimentiniu būdu gauta matematinė proceso išraiška parašyta tokia forma:
PV=k
Kur P ir V yra slėgis sistemoje ir jos tūris, k yra tam tikra konstanta, kurios reikšmė priklauso nuo dujinės medžiagos kiekio ir jos temperatūros. Jei sukursite P(V) funkcijos priklausomybę nuo grafiko, tai bus hiperbolė. Šių kreivių pavyzdys parodytas toliau.
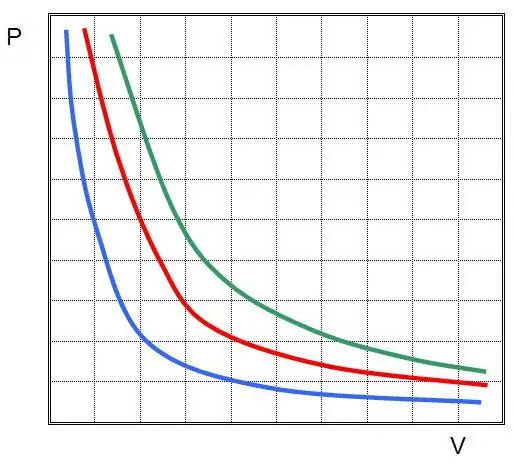
Parašyta lygybė vadinama Boyle-Mariotte lygtimi (dėsniu). Šį dėsnį galima trumpai suformuluoti taip: idealių dujų plėtimasis esant pastoviai temperatūrai sąlygoja proporcingą slėgio sumažėjimą jose, priešingai, izoterminį dujų sistemos suspaudimą lydi proporcingas slėgio padidėjimas joje.
Idealiųjų dujų lygtis
Boyle-Mariotte įstatymas yra ypatingas bendresnio įstatymo atvejis, pavadintas Mendelejevo irClapeyronas. Emile'as Clapeyronas, apibendrindamas eksperimentinę informaciją apie dujų elgesį įvairiomis išorinėmis sąlygomis, 1834 m. gavo tokią lygtį:
PV=nRT
Kitaip tariant, dujų sistemos tūrio V ir joje esančio slėgio P sandauga yra tiesiogiai proporcinga absoliučios temperatūros T sandaugai ir medžiagos n kiekiui. Šio proporcingumo koeficientas žymimas raide R ir vadinamas dujų universalia konstanta. Rašytinėje lygtyje R reikšmė atsirado dėl daugelio konstantų pakeitimo, kurį 1874 m. padarė Dmitrijus Ivanovičius Mendelejevas.
Iš universalios būsenos lygties nesunku suprasti, kad temperatūros ir medžiagos kiekio pastovumas garantuoja dešiniosios lygties pusės nekintamumą, o tai reiškia, kad ir kairioji lygties pusė išliks nepakitusi. Šiuo atveju gauname Boyle-Mariotte lygtį.

Kiti dujų įstatymai
Aukščiau esančioje pastraipoje parašyta Clapeyrono-Mendelejevo lygtis turi tris termodinaminius parametrus: P, V ir T. Jei kiekvienas iš jų yra fiksuotas, o kitiems dviem leidžiama keistis, gauname Boyle-Mariotte, Charleso ir Gay-Lussac lygtys. Charleso dėsnis kalba apie tiesioginį tūrio ir temperatūros proporcingumą izobariniam procesui, o Gay-Lussac dėsnis teigia, kad izochorinio perėjimo atveju dujų slėgis didėja arba mažėja tiesiogiai proporcingai absoliučiai temperatūrai. Atitinkamos lygtys atrodo taip:
V/T=const, kai P=const;
P/T=const, kai V=const.
TaigiTaigi Boyle-Mariotte dėsnis yra vienas iš trijų pagrindinių dujų dėsnių. Tačiau ji skiriasi nuo kitų grafine priklausomybe: funkcijos V(T) ir P(T) yra tiesės, funkcija P(V) yra hiperbolė.
Boyle-Mariotte dėsnio taikymo užduoties pavyzdys
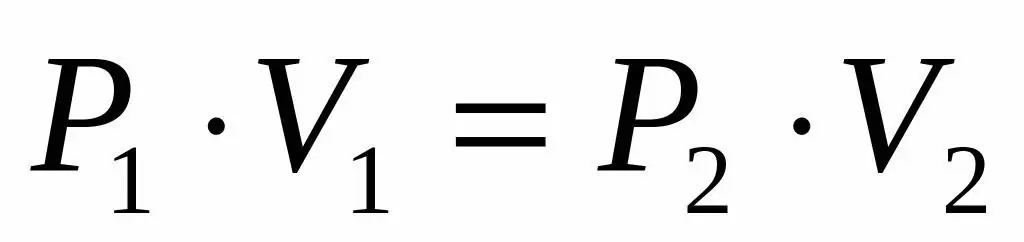
Dujų tūris cilindre po stūmokliu pradinėje padėtyje buvo 2 litrai, o slėgis - 1 atmosfera. Koks buvo dujų slėgis pakilus stūmokliui ir dujų sistemos tūriui padidėjus 0,5 litro. Procesas laikomas izoterminiu.
Kadangi mums pateikiamas idealių dujų slėgis ir tūris, taip pat žinome, kad temperatūra nesikeičia joms besiplečiant, todėl Boyle-Mariotte lygtį galime naudoti tokia forma:
P1V1=P2V 2
Ši lygybė sako, kad tūrio ir slėgio sandauga yra pastovi kiekvienai dujų būsenai tam tikroje temperatūroje. Iš lygybės išreiškę reikšmę P2, gauname galutinę formulę:
P2=P1V1/V 2
Atlikdami slėgio skaičiavimus, šiuo atveju galite naudoti nesisteminius vienetus, nes litrai susitrauks, o slėgį gauname P2atmosferose. Pakeitę duomenis iš sąlygos, gauname atsakymą į problemos klausimą: P2=0,8 atmosferos.






