Idealios dujos, idealiųjų dujų būsenos lygtis, jų temperatūra ir slėgis, tūris… atitinkamame fizikos skyriuje naudojamų parametrų ir apibrėžimų sąrašą galima tęsti gana ilgai. Šiandien kalbėsime tik šia tema.
Kas yra laikoma molekulinėje fizikoje?

Pagrindinis šiame skyriuje aptariamas objektas yra idealios dujos. Idealiųjų dujų būsenos lygtis buvo gauta atsižvelgiant į normalias aplinkos sąlygas, ir apie tai kalbėsime šiek tiek vėliau. Dabar pažiūrėkime į šią „problemą“iš tolo.
Tarkime, kad turime tam tikrą dujų masę. Jo būseną galima nustatyti naudojant tris termodinaminio pobūdžio parametrus. Tai, žinoma, yra slėgis, tūris ir temperatūra. Sistemos būsenos lygtis šiuo atveju bus atitinkamų parametrų ryšio formulė. Tai atrodo taip: F (p, V, T)=0.
Čia pirmą kartą pamažu artėjame prie tokio dalyko kaip idealas atsiradimodujų. Tai vadinama dujomis, kuriose molekulių sąveika yra nereikšminga. Apskritai gamtoje to nėra. Tačiau bet kurios labai išretintos dujos yra arti to. Azotas, deguonis ir oras, esantys normaliomis sąlygomis, mažai skiriasi nuo idealaus. Norėdami parašyti idealių dujų būsenos lygtį, galime naudoti vieningą dujų dėsnį. Gauname: pV/T=konst.
Susijusi sąvoka Nr. 1: Avogadro dėsnis
Jis gali mums pasakyti, kad jei paimsime tiek pat molių absoliučiai bet kokių atsitiktinių dujų ir patalpinsime jas tokiomis pačiomis sąlygomis, įskaitant temperatūrą ir slėgį, tada dujos užims tą patį tūrį. Visų pirma, eksperimentas buvo atliktas įprastomis sąlygomis. Tai reiškia, kad temperatūra buvo 273,15 kelvino, slėgis - viena atmosfera (760 milimetrų gyvsidabrio stulpelio arba 101325 paskaliai). Esant šiems parametrams, dujos užėmė 22,4 litro tūrį. Todėl galime sakyti, kad vienam moliui bet kokių dujų skaitinių parametrų santykis bus pastovi reikšmė. Štai kodėl buvo nuspręsta šį skaičių pažymėti raide R ir pavadinti universalia dujų konstanta. Taigi jis lygus 8,31. Vienetas yra J/molK.
Idealios dujos. Idealiųjų dujų būsenos lygtis ir jos manipuliavimas
Pabandykime perrašyti formulę. Norėdami tai padaryti, rašome tokia forma: pV=RT. Toliau atliekame paprastą veiksmą, padauginame abi lygties puses iš savavališko skaičiaus molių. Gauname pVu=uRT. Atsižvelgkime į tai, kad molinio tūrio sandauga irmedžiagos kiekis yra tiesiog tūris. Bet juk apgamų skaičius vienu metu bus lygus masės ir molinės masės daliniui. Būtent taip atrodo Mendelejevo-Clapeyrono lygtis. Tai leidžia aiškiai suprasti, kokią sistemą sudaro idealios dujos. Idealiųjų dujų būsenos lygtis bus tokia: pV=mRT/M.
Išveskite slėgio formulę
Padarykime dar keletą manipuliacijų su gautomis išraiškomis. Norėdami tai padaryti, dešinioji Mendelejevo-Clapeyrono lygties pusė padauginama ir padalyta iš Avogadro skaičiaus. Dabar atidžiai žiūrime į medžiagos kiekio sandaugą pagal Avogadro skaičių. Tai ne kas kita, kaip bendras molekulių skaičius dujose. Tačiau tuo pačiu metu universalios dujų konstantos ir Avogadro skaičiaus santykis bus lygus Boltzmanno konstantai. Todėl slėgio formules galima užrašyti taip: p=NkT/V arba p=nkT. Čia simbolis n yra dalelių koncentracija.
Idealūs dujų procesai
Molekulinėje fizikoje yra toks dalykas kaip izoprocesai. Tai termodinaminiai procesai, vykstantys sistemoje esant vienam iš pastovių parametrų. Šiuo atveju medžiagos masė taip pat turi išlikti pastovi. Pažvelkime į juos konkrečiau. Taigi, idealių dujų dėsniai.
Slėgis išlieka pastovus
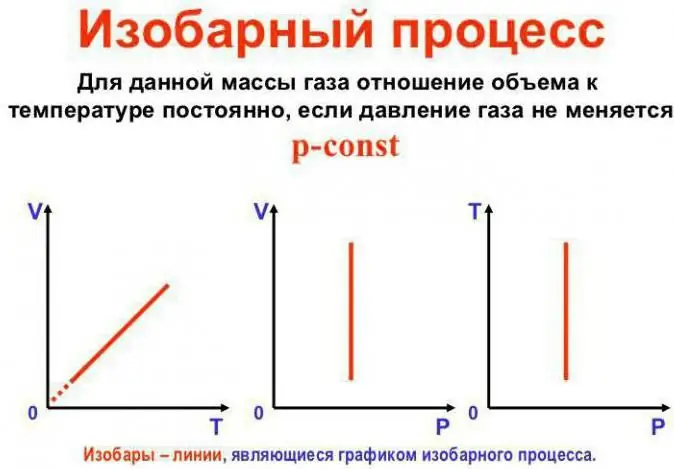
Tai yra Gay-Lussac dėsnis. Tai atrodo taip: V/T=konst. Jį galima perrašyti kitu būdu: V=Vo (1 + at). Čia a yra lygus 1/273,15 K^-1 ir vadinamas „tūrio plėtimosi koeficientu“. Temperatūrą galime pakeisti tiek Celsijaus, tiekKelvino skalė. Pastaruoju atveju gauname formulę V=Voat.
Garsumas išlieka pastovus

Tai antrasis Gay-Lussac dėsnis, dažniau vadinamas Charleso įstatymu. Tai atrodo taip: p/T=const. Yra ir kita formuluotė: p=po (1 + at). Transformacijas galima atlikti pagal ankstesnį pavyzdį. Kaip matote, idealių dujų dėsniai kartais yra gana panašūs vienas į kitą.
Temperatūra išlieka pastovi

Jei idealių dujų temperatūra išlieka pastovi, galime gauti Boyle-Mariotte dėsnį. Jį galima parašyti taip: pV=const.
Susijusi sąvoka Nr. 2: dalinis slėgis
Tarkime, turime indą su dujomis. Tai bus mišinys. Sistema yra šiluminės pusiausvyros būsenoje, o pačios dujos nereaguoja viena su kita. Čia N žymės bendrą molekulių skaičių. N1, N2 ir tt, atitinkamai, molekulių skaičius kiekviename mišinio komponente. Paimkime slėgio formulę p=nkT=NkT/V. Jis gali būti atidarytas konkrečiam atvejui. Dviejų komponentų mišinio formulė bus tokia: p=(N1 + N2) kT/V. Bet tada paaiškėja, kad bendras slėgis bus sumuojamas iš kiekvieno mišinio dalinių slėgių. Taigi, jis atrodys kaip p1 + p2 ir pan. Tai bus dalinis slėgis.
Kam tai skirta?
Mūsų gauta formulė rodo, kad slėgis sistemoje yra iš kiekvienos molekulių grupės. Beje, tai nepriklauso nuokiti. D altonas tuo pasinaudojo formuluodamas dėsnį, vėliau pavadintą jo vardu: mišinyje, kuriame dujos chemiškai nereaguoja viena su kita, bendras slėgis bus lygus dalinių slėgių sumai.






